El átomo es la parte más pequeña en la que puedes dividir un elemento. Suponiendo que pudieras cortar y cortar, por ejemplo, un trozo de aluminio, llegaría un momento en que llegarías al elemento más pequeño de aluminio que puedes tener y esto es un átomo. En caso que llegaras a cortar el átomo ya no tendrías aluminio.
Indice
DEFINICIÓN DE ÁTOMO
El concepto de átomo de forma estricta es la partícula más pequeña en la que se puede dividir un elemento sin perder sus propiedades químicas. Inicialmente la palabra átomo, de origen griego, quiere decir «indivisible». Hoy en día ya se conocen las partículas subatómicas de las que se compone un átomo y se sabe cómo un átomo puede ser fisionado.
ESTRUCTURA DEL ÁTOMO. ELECTRONES, PROTONES Y NEUTRONES
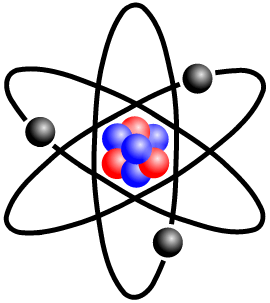
El átomo se compone de 3 partículas subatómicas (electrones, protones y neutrones). Estructuralmente se compone de un núcleo, y de una corteza. En el núcleo es donde se encuentra toda la masa del átomo.
ELECTRONES: Los electrones son partículas sin prácticamente masa, y con carga negativa. Se mueven alrededor del núcleo.
PROTONES: Los protones si tienen masa y se encuentran en el núcleo del átomo, junto a los neutrones. Los protones tienen carga positiva.
NEUTRONES: Los neutrones se encuentran en el núcleo del átomo, tienen la misma masa que los protones y no tienen carga. En el momento que aparece un isótopo donde hay 2 o más neutrones que protones, el átomo es inestable. (ver radioactividad)
Los protones, neutrones y electrones son las partículas subatómicas que forman la estructura del átomo. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.
COMO SE DIFERENCIAN LOS ÁTOMOS
Los elementos se sitúan por orden en la tabla periódica según su número atómico. El número atómico es la cantidad de protones en el núcleo.
La masa átomica viene determinada por el número de protones y neutrones del núcleo. Los electrones no se tienen en cuenta en la masa atómica por no tener apenas masa. Por poner algún ejemplo con los elementos más comunes:
- Oxígeno: Elemento num 8 en la Tabla Periódica, con 8 protones y 8 neutrones en el núcleo. Situada en la posición num 8 de la tabla, con masa atómica de 16.
- Carbono. Elemento num 6 en la Tabla Periódica, con 6 protones y 6 neutrones en el núcleo. Situada en la posición num 6 de la tabla, con masa atómica de 12.
ISÓTOPOS
El átomo de un mismo elemento puede variar en su número de neutrones en el núcleo. En este caso estamos hablando de un isótopo. La mayoría de los elementos tienen diferentes isótopos, que le dan diferentes características a los átomos. El isótopo más estable es el del átomo que tiene el mismo numero de neutrones que de protones.
En el momento que aparece un isótopo donde hay 2 o más neutrones que protones, el átomo es inestable, y emite radiaciones, conocidas como radiactividad. Casi todos los átomos tienen diferentes isótopos y la proporcion de isótopos por elemento se puede considerar constante. Así, ponemos 2 ejemplos muy conocidos:
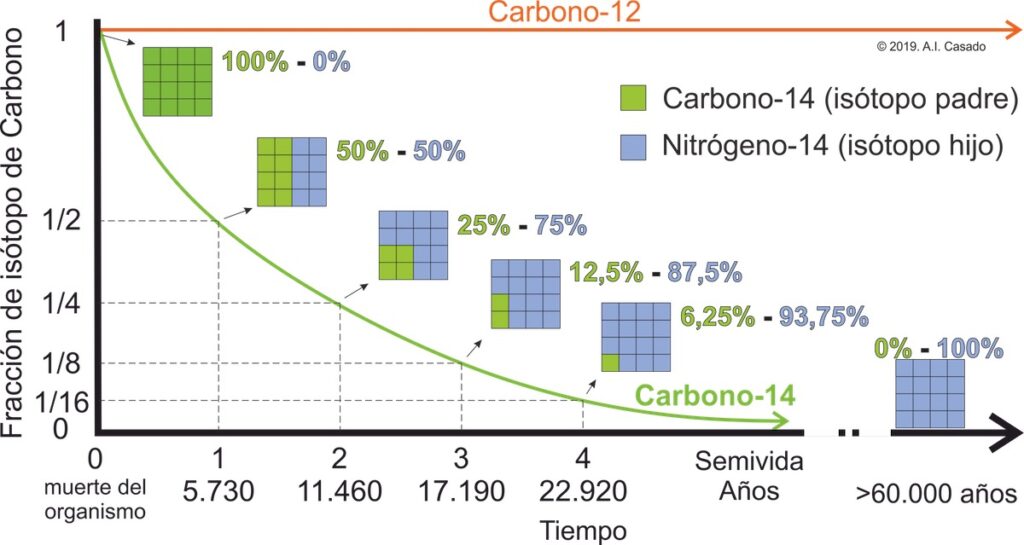
- En el caso del Carbono, tiene la siguiente proporción de isótopos: 98,89% de Carbono-12; 1,10% de Carbono-13 y solo 1,0×10-10 % de Carbono-14. Esta proporción es constante mientras q el organismo está vivo. En el momento que un organismo muere, la proporción entre sus isótopos de carbono comienza a cambiar. La cantidad de Cabono-12 se mantiene igual que cuando estaba vivo pero la cantidad de Carbono-14 disminuye debido a la inestabilidad de este isótopo. La curva de disminución del isótopo nos da los años en los que el organismo murió.
MODELO DE BOHR. NIVELES DE ENERGÍA. ELECTRONES POR CAPA
Según el modelo atómico de Bohr, los electrones se mueven en diferentes órbitas específicas y cada órbita con un nivel de energía específico. Cada electrón puede saltar de una órbita a otra, liberando energía en caso de que baje a una órbita de nivel de energía inferior y absorbiéndola en caso de que suba a una órbita de un nivel de energía superior.
Cada órbita, o cada nivel puede albergar diferentes niveles pueden albergar diferente número de electrones . Según la cantidad de electrones que tenga cada átomo va completando los diferentes niveles. En el primer nivel 2 electrones, en el nivel 2 hasta 8 electrones, y así sucesivamente según la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
Los átomos pierden o ganan electrones al reaccionar con otras sustancias, en base a lo que les falta o sobra para completar una capa. Un ejemplo, el hidrógeno que tiene 1 electrón, tiende a perderlo, quedándose con carga 1+. Esto es lo que se conoce como número de oxidación. Los elementos, como el Helio, que tiene sólo 2 electrones y tienen una capa estable completa, suelen ser muy poco reactivos y de ahí que se conozcan como gases nobles, por su poca o nula reactivdad.
El número de electrones de cada átomo lo puedes conocer a través de la tabla periódica. La tabla periódica está ordenada por el número de protones de cada elemento. Es decir el número atómico de la tabla periódica es el número de protones. Cada átomo tiene el mismo número de electrones que de protones.
EXPERIMENTOS RELACIONADOS CON ÁTOMOS
TABLA PERIÓDICA
La tabla periódica ordena a los átomos tanto por su número atómico (número de protones) como por su masa atómica y nos da gran información sobre cada uno de los elementos, según el grupo al que pertenecen.
ENLACES QUÍMICOS
Los enlaces químicos que se producen entre los átomos es la base de toda la comprensión de las propiedades de la materia, desde el punto de ebullición, de fusión, densidad, dureza, conductividad, reacciones… Aquí puedes leer todo sobre enlaces químicos, enlace iónico, enlace covalente y enlace metálico.
PROPIEDADES QUE DA LA ESTRUCTURA ATÓMICA
Casi todas las propiedades físico-químicas de los elementos nos la da su átomo: la densidad, conductividad, puntos de fusión y de ebullición,… También hay algunas características como la radioactividad o fluorescencia que viene definida por la estructura atómica de los elementos.
RADIOACTIVIDAD
La radioactividad es una de las propiedades de los átomos que más atrae y asusta a la vez. Se conocen los daños que causan los elementos radiactivos, y por otro lado se conoce la gran fuerza del núcleo atómico, a través de la fisión de su núcleo.
La radioactividad, en forma de radiaciones α, β y γ se produce cuando el núcleo no tiene el número de protones y neutrones equilibrado. Puedes ver más información sobre la radioactividad aquí: radioactividad.
FLUORESCENCIA
La fluorescencia es la capacidad que tienen determinados átomos para emitir luz visible cuando son irradiados con luz ultravioleta. Es un fenómeno realmente interesante, vistoso y además útil en muchas aplicaciones. Lee toda la información sobre la fluorescencia.
FUENTES
https://ptable.com/?lang=es#
