The octet rule o octet rule is a rule that is used in the context of the chemistry. The octet rule defines the property of atoms to complete their last energy level with eight electrons in order to achieve stability. Whether it is a ionic bond, covalent o metal, los átomos van a tender a ceder o compartir para completar 8 electrones en la capa de valencia.
El creador de esta regla es el científico Gilbert Newton Lewis y fue creada en 1917.
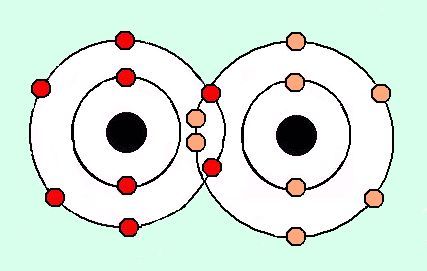
La base de esta regla son los gases nobles que tienen 8 electrones en su última capa y son los elementos menos reactivos de toda la periodic table. Lewis advirtió que al unirse diferentes iones entre sí, quieren lograr la configuración de un gas noble, consiguiendo 8 electrones en su última capa.
Esta regla se aplica en la creación de enlaces químicos entre los átomos. El comportamiento y las propiedades de las moléculas dependerán del tipo de enlace, número de enlaces por átomo y de las fuerzas intermoleculares.
Existen diferentes tipos de chemical bonding, según la electronegatividad de los elementos. En cualquiera de los enlaces, los átomos tienden a roadearse de 8 electrones en la capa más externa.
La mejor forma para ver de forma gráfica cómo funciona la «regla del octeto» es la representación de Lewis de las moléculas. Antes de escribir la representación de la Lewis structure hay que conocer cómo están unidos los átomos de verdad, ya que muchas veces la fórmula no representa las uniones entre átomos. Por ejemplo aunque la fórmula del ácido nítrico con frecuencia se representa como HNO3, en realidad el hidrógeno está unido a un oxígeno, no al nitrógeno. La estructura es HONO2 y no HNO3.
EXCEPCIONES REGLA DEL OCTETO
- The hidrógeno al tener un único orbital en su capa de valencia la cual puede aceptar como máximo dos electrones.
- The berilio se completa en su última capa con cuatro electrones.
- The boro que requiere de seis electrones para llevar a cabo esta función.
- The aluminio. El aluminio consigue la estabilidad con 6 electrones en su capa de valencia.
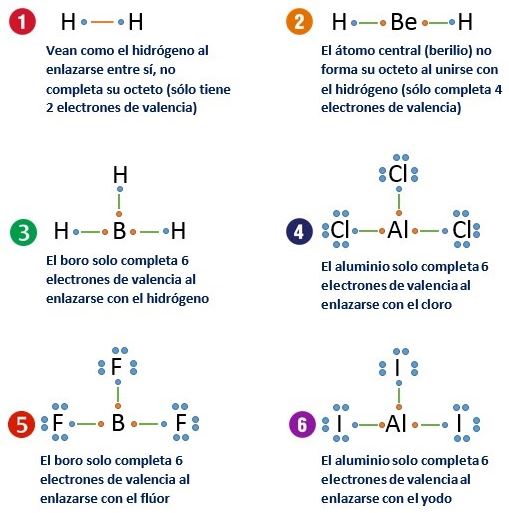
También los átomos no metálicos a partir del tercer período (Fósforo, yodo, xenón y Azufre) pueden pueden tener más que ocho electrones en su capa de valencia, colocando los electrones extra en subniveles.
